Introdução
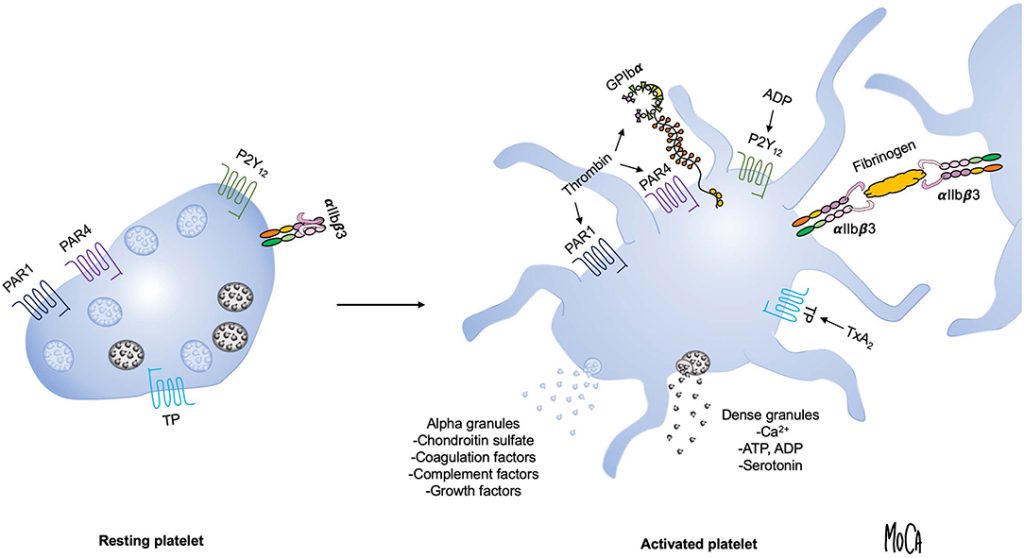
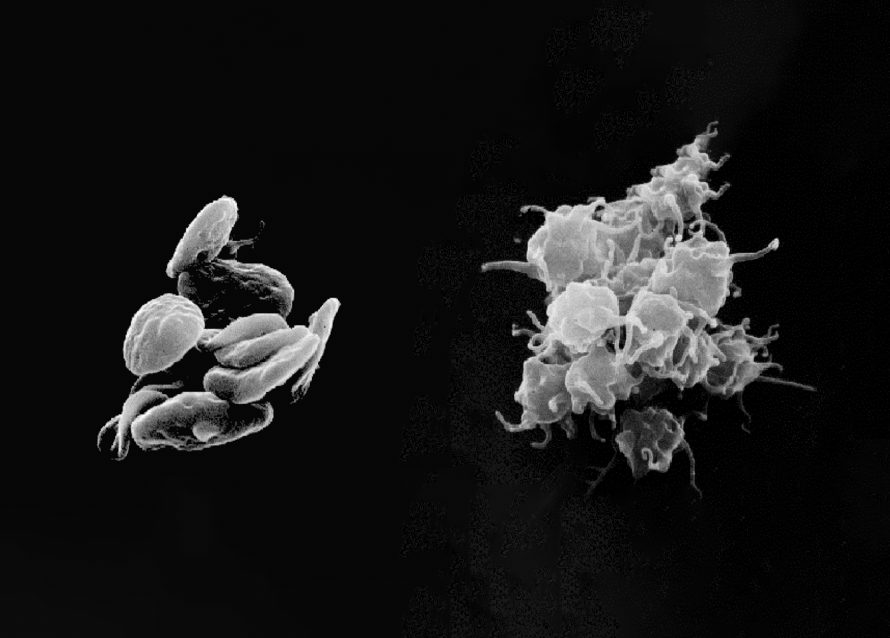
A terapia com plasma rico em plaquetas (PRP) depende não apenas da concentração de plaquetas, mas também de como e quando essas plaquetas são ativadas para liberar fatores de crescimento. Embora muitos protocolos incluam uma etapa de ativação ex vivo utilizando agentes como cloreto de cálcio ou trombina, outros clínicos preferem injetar o PRP em sua forma repousada, permitindo que o colágeno nativo e o microambiente tecidual ativem as plaquetas in situ.
Como destacado em uma revisão de 2016 (Everts et al., PMCID: PMC5031826), “a escolha da estratégia para ativar o PRP é baseada principalmente em razões práticas, em vez de ser sustentada por estudos sobre os efeitos dos diferentes procedimentos no secretoma final das plaquetas.” Compreender as implicações da estratégia de ativação plaquetária permite que os profissionais adaptem as preparações de PRP de forma mais precisa aos cenários clínicos específicos. Isso é particularmente crítico ao selecionar entre métodos de ativação apropriados para PRP pobre em leucócitos (LP-PRP), frequentemente usado em aplicações intra-articulares, e PRP rico em leucócitos (LR-PRP), tipicamente empregado no tratamento de lesões musculares ou tendíneas.
Métodos de Ativação Plaquetária – Classificação Abrangente
I. Ativação Física (Mecânica + Térmica)
Esses métodos utilizam forças físicas ou estresse térmico para induzir a ativação ou lise das plaquetas.
Mecânica
- Cisalhamento com Agulha: Forçar o PRP através de uma agulha de pequeno calibre (tipicamente 21G ou menor) gera estresse de cisalhamento mecânico, ativando parcialmente as plaquetas.
- Choque Centrífugo ou Agitação Manual: Desaceleração abrupta ou agitação vigorosa causa ruptura da membrana plaquetária, resultando em ativação parcial. Abrupt deceleration or shaking causes disruption to the platelet membrane, resulting in partial activation.
- Ciclos de Congelamento e Descongelamento: Lise completa das plaquetas por formação de cristais de gelo intracelular, geralmente utilizando congelamento a -80°C seguido de descongelamento a 37°C. Libera todo o conteúdo intracelular e é comumente usado para produzir lisado plaquetário.
Térmica
- Aquecimento Leve (37–42°C): Promove ativação plaquetária natural sem ruptura das membranas, imitando sinais fisiológicos.
- Lise Induzida por Congelamento: Funcionalmente idêntica ao congelamento-descongelamento, frequentemente agrupada na literatura devido ao mecanismo compartilhado de estresse térmico e mecânico. Functionally identical to freeze-thaw, often grouped together in literature due to the shared mechanism of thermal and mechanical stress.
Efeito: Os métodos físicos variam em grau de ativação. Congelamento-descongelamento causa lise completa e liberação descontrolada de fatores de crescimento, enquanto o cisalhamento com agulha e o aquecimento leve oferecem ativação parcial mais controlada, dependendo da intensidade e duração.
II. Ativação Química
Agentes clinicamente validados que oferecem ativação plaquetária controlada e reprodutível.
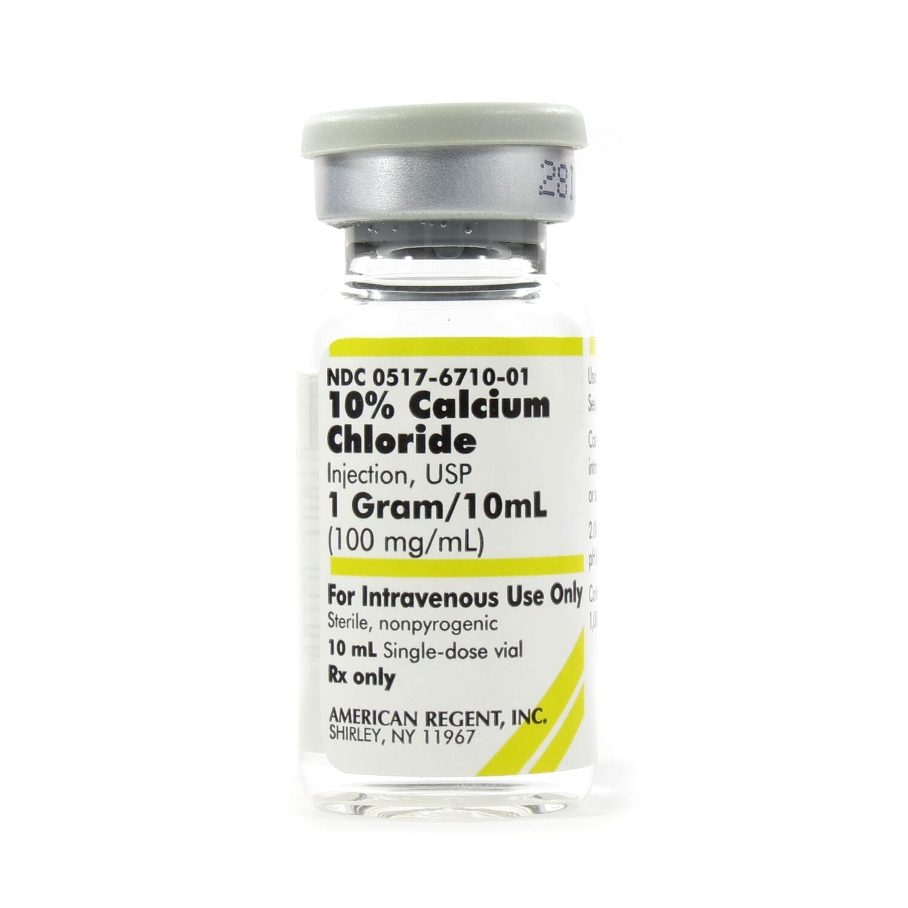
- Cloreto de Cálcio (CaCl₂): Inicia a cascata de coagulação e ativação plaquetária. Frequentemente utilizado em LP-PRP para aplicações intra-articulares. Oferece ativação forte, porém modulada, sem inflamação excessiva.
- Trombina (Autóloga ou Bovina): Potente ativador que induz rapidamente a desgranulação plaquetária. Preferida em ambientes cirúrgicos e para LR-PRP aplicado em lesões musculares ou de tecidos moles.
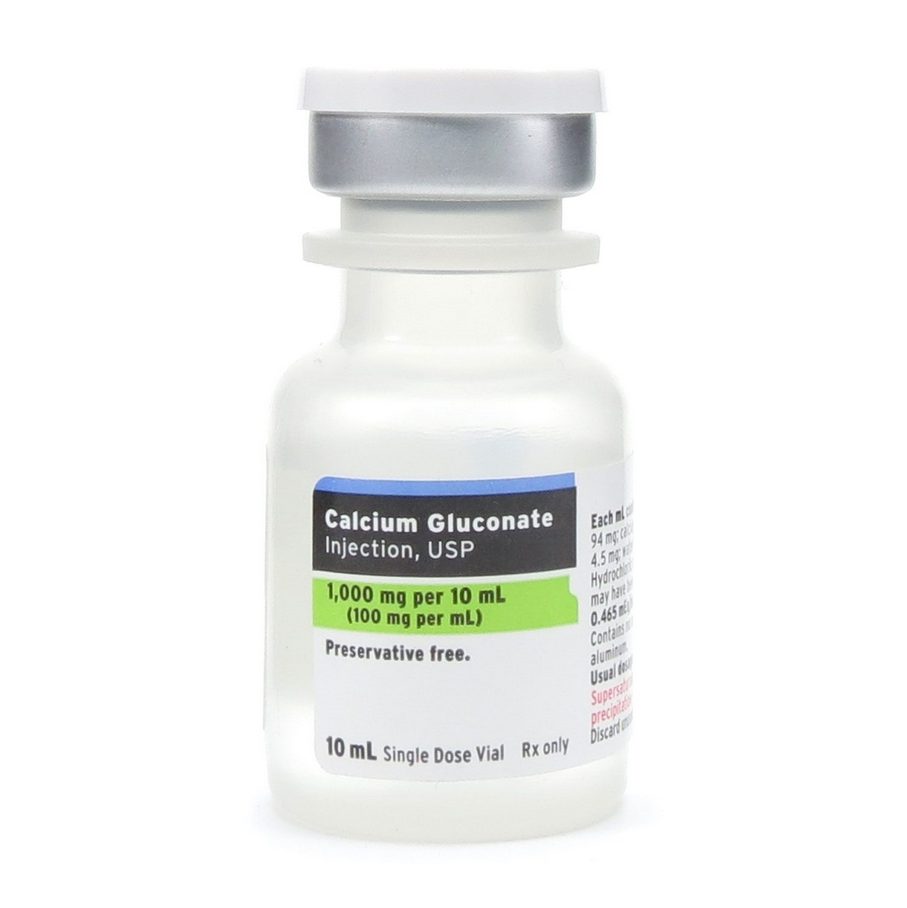
- Gluconato de Cálcio: Mais brando que o CaCl₂, capaz de formar uma matriz de fibrina e ativar as plaquetas. Usado em protocolos que preferem liberação gradual ou menor atividade procoagulante.
- Colágeno (Tipo I ou Fragmentos Peptídicos): Liga-se aos receptores da superfície plaquetária para mimetizar a lesão vascular natural. Menos utilizado na prática clínica devido à complexidade e variabilidade dos materiais.
- Bicarbonato de Sódio (adjunto): Às vezes usado para modular o pH ou em combinação com cálcio para melhorar a formação da matriz de fibrina. Raramente usado sozinho para ativação principal.
Efeito: Os ativadores químicos oferecem controle preciso sobre a ativação plaquetária e formação de fibrina. A escolha do agente afeta a cinética do coágulo, o potencial inflamatório e o tempo de liberação dos fatores de crescimento.
III. Ativação Ultrassônica (Baseada em Ultrassom)
Método sem contato que ativa plaquetas por estresse mecânico gerado por ondas acústicas.
- Mecanismo: O ultrassom de baixa ou alta intensidade gera cavitação e forças de cisalhamento que rompem membranas plaquetárias e estimulam a desgranulação.
- Parâmetros Típicos: Frequências em torno de 1 MHz, intensidades de 1–2 W/cm², com exposições entre 30 segundos e 2 minutos.
Vantagens:
- Sem aditivos químicos
- Estéril e ajustável
- Permite ativação direcionada espacialmente
Limitações:
- Requer equipamentos especializados
- Menos comum em protocolos clínicos padrão
- Potencial para superaquecimento ou ativação excessiva em altas intensidades
Aplicação I: LP-PRP para Injeções Intra-Articulares
Objetivos: Resposta anti-inflamatória controlada, liberação sustentada de fatores de crescimento (GF), mínimo de leucócitos/fibrina.
Melhor Ativador: Gluconato de Cálcio
- Fornece liberação de íons cálcio mais lenta e sustentada
- Leva à liberação prolongada e direcionada de fatores de crescimento
- Alinha-se com ambientes articulares de baixa vascularização e cicatrização lenta
- Perfil inflamatório mais baixo em comparação ao CaCl₂ ou trombina
Alternativa: PRP em Repouso (Sem Ativação)
- Ativado por colágeno nativo em cartilagem/matriz sinovial (Everts et al., 2016)
- Promove precisão espacial na liberação de GF no local da lesão
- Preserva consistência fluida, facilitando a injeção articular
Advertências:
- Início retardado do efeito terapêutico
- Variabilidade dependendo do estado tecidual e da exposição ao colágeno
- Formação de fibrina limitada, a menos que o cálcio esteja presente
Benefício de Múltiplas Injeções: Devido ao suprimento vascular inerentemente baixo da cartilagem intra-articular e tecido sinovial, a entrega de nutrientes e fatores de crescimento a essas regiões é naturalmente lenta e limitada. Um único bolus de PRP ativado pode não sustentar seus efeitos por tempo suficiente para impactar significativamente o remodelamento tecidual. O uso de PRP não ativado ou de ativação lenta — como com gluconato de cálcio — alinha-se com uma vantagem teórica para dosagem seriada. Ao realizar múltiplas injeções ao longo do tempo, é possível manter uma concentração terapêutica de fatores de crescimento na articulação à medida que a resposta cicatricial progride.
Evidência clínica:
- Dai et al., 2023: Multi-injection PRP better than HA at 3, 6, and 12 months (PMC10057845)
- Xing et al., 2024: 3 injections optimal vs. 1 or 5 (PMC11077828)
- Korpershoek et al., 2024: Improved function and pain with repeated PRP (PubMed 38392616)
Explicação da Precisão Espacial:
- PRP ativado libera GF sistemicamente, com risco de dispersão fora do alvo
- Resting PRP and slow-activating agents like calcium gluconate activate PRP em repouso e agentes de ativação lenta como o gluconato de cálcio ativam somente no local da lesão, concentrando a ação terapêutica, focusing therapeutic payload
- Maior biodisponibilidade de GF no ponto de interesse, com menor risco inflamatório sistêmico
Aplicação II: LR-PRP para Tratamento de Lesões Musculares
Objetivos: Liberação imediata de GF, formação de matriz de fibrina, recrutamento imune
Melhor Ativador: Trombina Autóloga
- Ativação rápida e completa
- Cria uma matriz de fibrina que favorece a adesão tecidual
- Suporta reparo agudo, especialmente em tendões e músculos
Alternativas:
- CaCl₂ se uma liberação mais lenta for aceitável
- Ultrassom para ativação moderada sem aditivos
Evitar: LP-PRP (baixo teor de leucócitos menos ideal para reparo muscular); ativadores leves como aquecimento ou cisalhamento fraco
Gluconato de Cálcio vs. Cloreto de Cálcio: Implicações em uso IA
Cloreto de Cálcio:
- ~27% de cálcio elementar
- Dissociação rápida, ativação imediata
- Ideal para efeitos terapêuticos agudos
Gluconato de Cálcio:
- ~9% de cálcio elementar
- Liberação mais lenta, ativação sustentada
- Perfil inflamatório mais leve
Considerações Articulares:
- Cartilagem e sinóvia têm fluxo sanguíneo mínimo
- A cicatrização é lenta; liberação gradual de GF favorece esse processo
- O gluconato de cálcio pode sincronizar melhor com o ritmo de regeneração (PMC9339933)
Nota sobre ACD-A e Ativação com Cálcio
A maioria dos sistemas de preparo de PRP utiliza ACD-A (solução de ácido cítrico com dextrose) como anticoagulante. O ACD-A atua quelando íons cálcio livres, impedindo a coagulação e a ativação espontânea das plaquetas. Contudo, isso afeta diretamente os ativadores químicos. Se o citrato não for neutralizado adequadamente, ele continua a se ligar ao cálcio, inibindo a eficácia de ativadores como o cloreto ou o gluconato de cálcio. Para obter ativação confiável, é necessário adicionar uma quantidade suficiente de cálcio para superar a ação quelante do citrato.
Conclusão: Em aplicações intra-articulares, o gluconato de cálcio pode ser teoricamente superior ao cloreto de cálcio devido à sua cinética de ativação retardada, que se alinha melhor aos processos de reparo biológico prolongado em espaços articulares com baixa vascularização. Seu uso pode favorecer uma sinalização trófica sustentada ao longo de várias semanas durante a cicatrização da cartilagem, especialmente em protocolos com múltiplas injeções.
Leitura Complementar Sugerida
Para aprofundar-se nos mecanismos de ativação plaquetária e suas interações imunológicas, recomendamos a seguinte revisão de acesso aberto:
- Assinger, A. (2019). Platelets and innate immunity: mechanisms and interactions. Frontiers in Immunology, 10, 1590. https://www.frontiersin.org/articles/10.3389/fimmu.2019.01590/full
Referências
- Everts, P. A., et al. (2016). Reviewing the mechanisms of platelet-rich plasma therapy in musculoskeletal injuries and osteoarthritis. International Journal of Molecular Sciences, 17(8), 1123. PMCID: PMC5031826.
- Dai, W. L., et al. (2023). The efficacy of platelet-rich plasma for knee osteoarthritis: A systematic review and meta-analysis. BioMed Research International, 2023. PMCID: PMC10057845.
- Xing, J., et al. (2024). Three versus five PRP injections for knee osteoarthritis: A randomized controlled trial. International Orthopaedics, 2024. PMCID: PMC11077828.
- Korpershoek, J. V., et al. (2024). Repeated intra-articular PRP injections improve knee function and reduce pain: A longitudinal cohort study. Journal of Orthopaedic Research. PubMed ID: 38392616.
- Zhou, Y., et al. (2016). Ultrasound-induced platelet activation for biomedical applications. Journal of Translational Medicine, 14, 335.
- Shen, L., et al. (2013). Optimization of ultrasound parameters for platelet activation. Ultrasound in Medicine & Biology, 39(6), 1056–1065.
- Al-Hamed, F. S., et al. (2022). Comparative evaluation of calcium chloride and calcium gluconate in PRP activation. Journal of Clinical Medicine, 11(17), 5035. PMCID: PMC9339933.
Deixe um comentário